Salah satu tipe reaksi kimia sebagai dasar penetapan titrimetri adalah pembentukan kompleks atau ion kompleks yang larut namun sedikit sekali terdisosiasi. Jadi titrasi kompleksometri adalah jenis titrasi dengan titran dan titrat saling mengompleks, membentuk hasil berupa senyawa kompleks. Salah satu contoh adalah reaksi ion perak dengan ion sianida membentuk ion kompleks Ag(CN) yang sangat stabil.
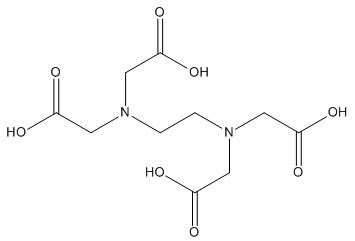
Hanya beberapa ion logam seperti tembaga, kobalt, nikel, seng, kadmium, dan merkurium (II) yang membentuk kompleks stabil dengan ligan nitrogen seperti amonia dan trietilendiamin. Ion logam lain misalnya aluminium, timbal dan bismut, dikomplekskan secara lebih baik oleh ligan yang mengandung atom oksigen sebagai penyumbang pasangan elektron. Zat pengkhelat tertentu yang mengandung baik oksigen maupun nitrogen teristimewa efektif dalam membentuk kompleks yang stabil dengan logam, yang sangat beraneka ragam antara lain etilendiamintetraesetat / ethylendiaminetetraacetic (EDTA). Rumus struktur EDTA seperti ditunjukkan pada gambar di bawah ini:
Kompleksometri dalam perkembangan analisis kimia mengalami kemunduran karena kelemahannya serta adanya cara-cara baru yang lebih baik. Tetapi dengan penelitian-penelitian tentang pengkhelat polidentat, maka terjadi kebangkitan baru dalam analisis unsur logam. Perhatian baru terhadap kompleksometri ini terutama diawali oleh Schwarzenbach di Swiss, yang menyadari potensi pengkhelat dalam analisis volumetrik, dan mulai mengembangkannya pada tahun 1945. Perhatian utama tertuju pada asam-asam aminopolikarboksilat, salah satu diantaranya adalah EDTA. Bahan-bahan pembentuk khelat lain juga dikembangkan.
Hanya beberapa ion logam seperti tembaga, kobalt, nikel, seng, kadmium, dan merkurium (II) yang membentuk kompleks stabil dengan ligan nitrogen seperti amonia dan trietilendiamin. Ion logam lain misalnya aluminium, timbal dan bismut, dikomplekskan secara lebih baik oleh ligan yang mengandung atom oksigen sebagai penyumbang pasangan elektron. Zat pengkhelat tertentu yang mengandung baik oksigen maupun nitrogen teristimewa efektif dalam membentuk kompleks yang stabil dengan logam, yang sangat beraneka ragam antara lain etilendiamintetraesetat / ethylendiaminetetraacetic (EDTA). Rumus struktur EDTA seperti ditunjukkan pada gambar di bawah ini:
Kompleksometri dalam perkembangan analisis kimia mengalami kemunduran karena kelemahannya serta adanya cara-cara baru yang lebih baik. Tetapi dengan penelitian-penelitian tentang pengkhelat polidentat, maka terjadi kebangkitan baru dalam analisis unsur logam. Perhatian baru terhadap kompleksometri ini terutama diawali oleh Schwarzenbach di Swiss, yang menyadari potensi pengkhelat dalam analisis volumetrik, dan mulai mengembangkannya pada tahun 1945. Perhatian utama tertuju pada asam-asam aminopolikarboksilat, salah satu diantaranya adalah EDTA. Bahan-bahan pembentuk khelat lain juga dikembangkan.










0 komentar:
Posting Komentar